理论研究检查了能量制造酶ATP合成酶内的电场,暗示它具有比教科书中报道的更高的酶效率。1对酶分子静电势的计算表明,电场的变化有助于质子的运动以及ATP的形成,表明酶的作用超过了它的生物催化功能。
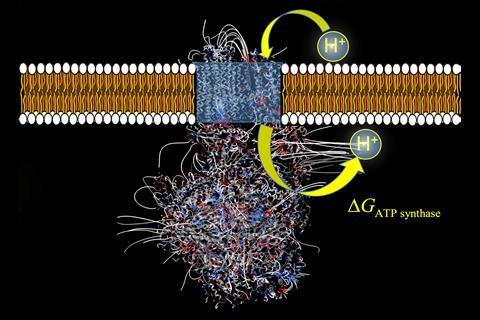
ATP(三磷酸腺苷)是所有活细胞的能量货币。大部分ATP是由ATP合酶在线粒体中合成的,ATP合酶在线粒体内膜内完成了复杂电子转移链的最后一步。为了驱动ADP(二磷酸腺苷)和磷酸盐到ATP的能量昂贵的转换,这种酶利用了与电子转移链中产生的电化学梯度相关的能量,通过将质子泵回膜上。
大多数教科书引用ATP合酶的效率约为55%,这是根据葡萄糖从食物氧化到ATP的自由能值计算得出的。然而,这些计算通常没有考虑ATP合酶在将质子运输回膜中的作用。为了从背景热噪声中识别和选择穿越膜的质子,酶必须消耗能量来抵消质子迁移带来的熵减少。现在,计算Cherif马特加拿大圣文森特山大学的教授和他的同事确定了ATP合酶内的电场,并解释了ATP合酶如何在耗散质子选择能量的同时发挥作用。计算还指出ATP合酶的热力学效率要高得多。
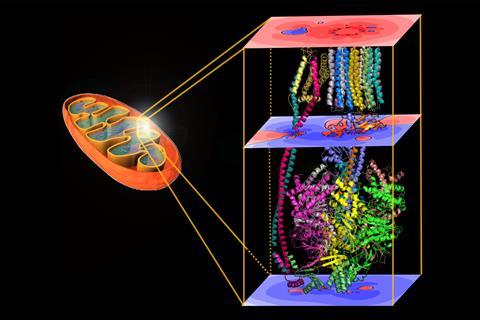
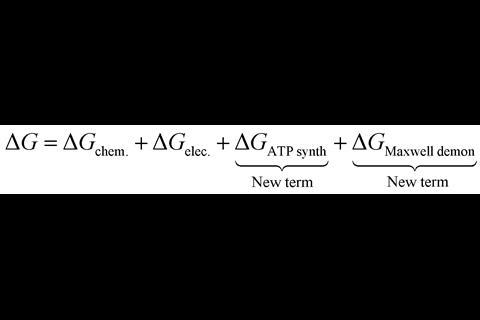
Matta的团队通过计算沿质子运动方向的电场,计算了来自五种不同物种的ATP合酶的分子静电势。这些计算显示了质子通过酶进入和退出点之间的电压差,以及质子进入点的潜在峰值。这两个观察结果都转化为新的自由能项,以添加到ATP合成的自由能方程中。
“作为催化剂,酶不会干扰反应的自由能,但ATP合酶却不是这样,”Matta说。Matta团队提出的新的自由能项与ATP合酶在催化ATP形成之外的两个新角色相关。首先,质子进入和退出之间的电位差建设性地增加了线粒体内膜的电化学梯度,补偿了质子选择能的耗散,并改变了质子易位的自由能。其次,质子进入时的电位峰值代表了一种动力学障碍,表明ATP合酶也是质子迁移的调节因子。这种酶的这些新作用加强了先前的估计,即ATP合酶的真正效率约为90%。
苏尼尔•纳他是印度理工学院德里分校的高级研究员,他提出了一种ATP合成的扭转机制,在这种机制中,酶也利用与离子易位相关的旋转运动的能量,2他指出,“这项工作的一个有趣的方面是,分子静电势为通过ATP合酶的质子易位创造了一个动力学障碍。Nath补充说,有关这种动力学屏障如何影响质子通过酶的持续迁移的机制研究对于充分理解ATP合酶如何实现能量转导是必要的。
Matta谨慎地指出,这些发现只代表了五种ATP合酶结构,并强调这些电场计算是针对被水包围的酶,而不是嵌入线粒体内膜的酶。然而,当考虑到膜时,研究人员预测了更大的计算电位差异,其中酶的作用甚至超出了其催化功能,因此它的真实酶效率实际上可能接近100%。
参考文献
1 J-N维尼奥等,化学。Commun。, 2022,58, 2650 (doi:10.1039 / d1cc06793a)
2 S Nath,生物。理论物理。, 2021,47, 401 (doi:10.1007 / s10867 - 021 - 09591 - 8)









暂无评论