安迪·埃文斯讲述了Arc蛋白质及其衣壳形式的惊人故事,以及它提出的问题
自1995年被发现以来,一种名为Arc的蛋白质逐渐揭示了人们长期寻找的记忆工作原理的秘密——但到了2013年,杰森·谢博德对它“有点厌倦”了。他从2001年本科学习起就开始研究Arc。到2013年,当他在美国犹他大学建立他现在的实验室时,他认为“我们已经弄清楚了它的大部分功能”。但在五年内Shepherd的团队发表了他称这是像我们这样的哺乳动物在Arc版本中“完全出乎意料”的发现。与此同时,美国马萨诸塞大学的Vivian Budnik团队发表了类似的发现在果蝇中发现的Arc版本这一发现强化了早期的一种观点,即数百万年前,复杂的生命形式找到了一种方法,利用现代逆转录病毒(如HIV)的祖先来帮助我们思考。
2018年,两个团队都证明了Arc可以形成类似于病毒的衣壳,并在细胞之间携带RNA遗传信息。这个绝妙的想法让科学家们感到惊讶,部分原因是他们对Arc的结构没有全面的了解,对哺乳动物的Arc结构也没有。Shepherd说:“结构可以给你一些线索。manbetx手机客户端3.0.“哪些部分从衣壳里伸出来,哪些部分伸进衣壳里,这就决定了装载的是什么。”
自从巴德尼克和谢泼德的团队揭示了Arc病毒性质的程度,研究人员就揭示了更多关于它的结构和功能的信息。一些人正试图最终确定一个完整的三维图像。与此同时,其他人正在努力进一步阐明Arc在非衣壳形式下是如何帮助我们存储记忆的。谢泼德的团队正准备在动物身上进行实验,以证明Arc的衣壳结构是否会影响记忆。巴德尼克的团队正在复杂的生命形式中寻找其他衣壳形成蛋白质。在所有这些研究方向上,Arc的发现有望揭示更多关于病毒样蛋白质是如何使我们成为我们的。
这些都是Arc研究我们如何学习的主要观点的最新进展,被称为突触可塑性和记忆假说。突触是大脑中大约850亿个神经元中两个神经元相遇的地方。电信号可以通过第一个神经元进入,并导致它释放化学信号,如谷氨酸神经递质,进入突触。第二个神经元在突触的另一侧有感受器来检测信号。根据第二个神经元发生的情况,它可能会发送自己的电信号。第二个神经元是否兴奋会改变突触,这种可变性被称为可塑性。
如果第二个神经元在第一个神经元之后被激活,它可能会获得谷氨酸受体,使第二个神经元更有可能在未来第一个神经元被激活时被激活。科学家将其称为强化或长期增强(LTP)。如果第二个神经元在第一个神经元之后没有被激活,那么一些谷氨酸受体可能会被移除,使得下一次在第一个神经元之后被激活的可能性降低。这被称为减弱,或长期抑郁(LTD)。日本东京大学的Haruhiko Bito称对谷氨酸敏感的受体数量为“突触上的货币”。当这些变化持续存在时,当一个生物体有类似的思维过程时,它的神经元会再次以同样的方式放电。这一过程持续不断,规模巨大,是我们形成记忆的核心部分。
适者生存的记忆
在20世纪90年代,Bito帮助展示了一种名为CREB的转录因子如何启动用于从遗传指令中制造蛋白质的机制,以帮助突触变化持续下去。比托和其他科学家想要找出转录机制正在读取哪些基因。比托回忆说,Arc“是比较有趣的一种”,因为它存在于突触中,并被大量转录。
为了让最强壮的存活,你需要移除最虚弱的
科学家们认为,为了形成长期记忆,突触以某种方式被标记,使它们收集并使用LTP和LTD期间产生的附近蛋白质。研究人员称之为突触标记和捕获(STC)。出乎意料的是,Arc所做的几乎是相反的,Bito的团队的工作表明。在这种情况下,不是包括至少一个活跃神经元的突触被标记完全不活跃的突触被标记.然后,Arc有助于削弱它们之间的联系,因此当一个神经元被激发时,它的邻居就不太可能被激发。比托说,这是适者生存。为了让最强的存活下来,你需要移除最弱的。
Arc的重要性广泛而深远,包括许多生物生命开始的关键时期。2017年,比托与谢泼德的团队和其他人合作,帮助证明了这一点弧基因被表达使年轻老鼠比年老老鼠产生更高水平的蛋白质。在关键时期缝合闭上一只眼睛会永久性地恶化这只眼睛的视力。增加Arc水平延长了小鼠的关键期,实际上增加了成熟小鼠的可塑性,重新开启了它们的关键期。迄今为止,研究人员还没有完全了解其中所涉及的精确生化细节。
这是挪威卑尔根大学的Clive Bramham团队正在努力解决的问题。和Bito一样,卑尔根大学的研究人员在研究大脑的蛋白质转录机制时也找到了Arc。2002年,研究小组发现,刺激CREB的BDNF正在启动Arc合成。从那时起,他们利用显微镜和x射线散射技术研究了Arc的分子功能。他们发现,在细胞内部,Arc与谷氨酸受体本身结合。当它这样做时,它会与其他将受体固定在突触上的蛋白质竞争。Bramham解释说:“当Arc在突触中产生时,它将处于一个能够移除受体的位置。”受体可以在细胞膜上自由移动,或者通过内吞作用被拉入细胞。
逐渐形成衣壳
这只是Arc的众多角色之一。许多实验室已经证明它是一种灵活的蛋白质,可以作为一个互动中心,结合许多不同的分子。Bramham说:“它通过特定的效应蛋白来调节可塑性。”甚至在2018年衣壳发现之前,科学家就知道单个Arc链有自己的作用,或者可以抓住其他链,形成成对或四组。但除此之外,还不清楚大多数这样的功能在分子水平上是如何运作的。
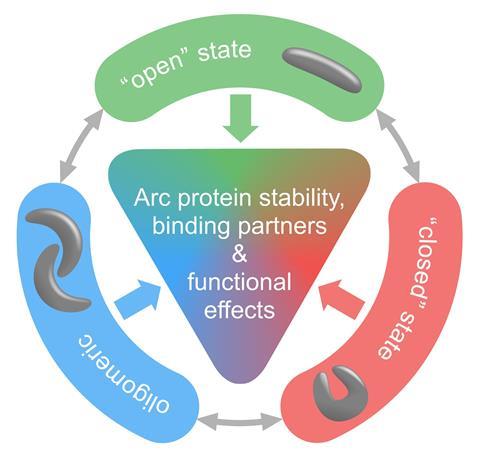
Arc有两个部分帮助它以不同的形式在突触的加强和削弱中发挥作用。c端结构域已经得到了充分的研究,看起来像艾滋病毒等逆转录病毒的衣壳蛋白。根据Bramham的说法,哺乳动物的形式有一个“漂亮的、多汁的、可能可药物的、疏水的结合袋”,这在其苍蝇或病毒形式中不存在。布拉姆姆说:“约翰霍普金斯大学保罗·沃利的实验室发现了这个口袋,为Arc如何调节细胞内信号和可塑性提供了一个重要的分子线索。”口袋的结构有助于展示它如何绑定不同的伙伴,并充当一个枢纽。他认为,也许有一天可以设计出增强或阻断相互作用的药物。然而,进一步了解它如何结合这么多不同的分子仍然很重要。
另一部分,n端结构域(NTD)是Arc链如何连接在一起构建更大结构的关键。使用全内反射显微镜,Bramham的团队可以看到有多少个Arc分子任何时候都在一起。这表明,RNA通过Arc NTD中的一个短片段触发Arc组装成衣壳大小的结构,并且是Arc与自身结合并形成衣壳所必需的。“虽然我们没有整个NTD的晶体结构,但我们获得了调节自我结合的部分的晶体结构,”Bramham说。
巴德尼克的团队在研究了神经突触的可塑性后发现了Arc衣壳果蝇果蝇,以及突触两侧的细胞如何协调。他们发现,主要由脂肪和蛋白质组成的微小球体,即细胞外囊泡,在帮助突触发育方面非常重要。Budnik解释说,细胞外囊泡可以通过突触运输RNA。她说:“它们可以改变其他细胞的遗传功能。”这两个版本弧RNA和Arc蛋白果蝇她的团队发现,它们是这些囊泡中最常见的货物。
当时,巴德尼克的同事特拉维斯·汤普森(Travis Thompson)刚刚加入她的团队。他是涉及反转录转座子的生物途径方面的专家,这种基因复制并重新插入到其主人的遗传密码中。它们通过逆转录将RNA转化为DNA,并将其与宿主的基因组整合,从而形成衣壳。这与HIV等逆转录病毒使用的技巧相同。巴德尼克指出,有些人认为逆转录病毒是从逆转录转座子进化而来的。“它们进化,获得了这些包膜蛋白,使它们能够从细胞中出来,进入其他细胞并感染它们。她补充说,这类基因占人类基因组的一半以上,因此经常被视为垃圾DNA而被忽视。
绘制详细的地图
汤普森注意到Arc的氨基酸看起来像逆转录病毒的逆转录转座衣壳区域中的氨基酸。巴德尼克说,科学家们以前注意到了这一点,但从未弄清楚为什么会这样。“所以我们问‘我们能形成衣壳吗?她回忆道。她的团队通过在细菌中编码这种蛋白质的基因序列来制造这种蛋白质,并制成了他们可以用电子显微镜看到的衣壳。衣壳也含有RNA,其中一些编码Arc。然后他们继续从细胞外囊泡中分离出Arc衣壳。在发表这些发现之前,巴德尼克看到谢泼德在一次会议上发表了类似的结果。她说:“这非常有趣,因为我们从一个角度出发,在没有任何交流的情况下,他从生物化学的角度得出了相同的结论。”“所以我们决定在这一点上并行发送我们的论文。”
目前,马萨诸塞州团队的注意力已经转向了另一种逆转录转座子基因,它有一个重要的工作,叫做Copia.她说:“这开启了这样一种想法,也许这些东西被驯化了,以许多不同的方式被细胞使用。”“它们已经进化了数十亿年,非常完美,你可以在不同的环境中使用它们。”
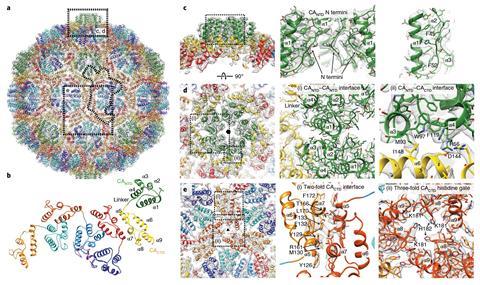
英国剑桥大学分子生物学实验室的Simon Erlendsson和John Briggs最近对这种进化历史有了更多的了解。随着Arc组装成衣壳的情况逐渐明朗,Erlendsson和Briggs与Shepherd合作研究Arc的结构和功能以及病毒样衣壳。Erlendsson说:“在果蝇中,我们既知道全长蛋白质本身的结构,也知道蛋白质形成病毒样衣壳时的结构。”“衣壳包含240个Arc蛋白的独立副本。”
LMB的研究人员还从晶体学和核磁共振两方面获得了哺乳动物c端结构域的3D结构。它包含Arc大约400个氨基酸残基的一半。“然而,我们仍然缺少哺乳动物Arc衣壳的详细分子图谱,”Erlendsson承认。Arc可以结合RNA、DNA、脂质、其他蛋白质和自身。当它和其中一个或全部结合时,会形成不同的络合物。虽然从生物学的角度来看,这完全说得通,但这让他们很难相处。”
衣壳的挑战
Erlendsson解释说,Arc基因可能在2.5亿年前被引入我们的基因组,这使得很难知道它究竟是如何到达那里的。他说:“然而,从我们的结构可以明显看出,Arc蛋白和衣壳与长端重复逆转录转座子(如Ty3)和逆转录病毒(如HIV)高度相似。”“一种假设是,由于无法去除或沉默Arc基因,导致了该基因的驯化。”“这意味着我们已经将Arc重新用于执行大脑中与记忆和学习相关的其他功能。”Erlendsson说,类似逆转录病毒的信号可能与大脑最宝贵的功能之一有关,这种可能性“令人震惊”。
然而,Erlendsson对这种知识可能导致药物的想法持谨慎态度。他说:“目前,很难预测药物中和Arc的作用会对生理产生怎样的影响——相同的结合袋结合了许多不同的配体。”“Arc的药理学兴趣主要是由于它能够形成病毒样衣壳。Arc衣壳可能被用来在大脑中运输货物,就像它们运输和保护自己的遗传物质一样。”
我们仍然缺少哺乳动物Arc衣壳的详细分子图谱
Shepherd认为Arc可能在重新开启临界可塑性期方面具有治疗潜力。他解释说:“你可以用它来治疗创伤性脑损伤或中风后的恢复。”“我们正在试图弄清楚这种衣壳细胞间的信号传递是否与阿尔茨海默氏症有关。”
除了充分了解哺乳动物Arc的3D结构外,Shepherd还想知道衣壳的形成时间和地点。“这很难,因为在任何给定的时间里,可能都不会产生很多蛋白质,因为你需要大量的蛋白质。”“部分挑战在于每个衣壳可能只包含4个RNA分子,这远远不足以制造另一个衣壳所需的蛋白质。”
谢泼德的下一步是进行动物实验,以充分探索衣壳的结构是如何决定其功能的。“我们已经在培养神经元上做了实验;他说,真正的问题在于大脑。谢泼德和他的同事们几乎已经完成了所需实验系统的开发。然而,他警告说,他们可能会发现,与记忆有关的只是更简单的Arc系统,而不是衣壳形式。谢泼德说,如果衣壳参与其中,“它为思考信息是如何存储的开辟了许多新的途径”。但在我们证明这一点之前,一切都是徒劳的。
不管我们的突触是否经常以类似病毒的方式直接传递信息,Arc已经揭示了生物化学使我们成为我们的新方式。我们现在知道它的古老病毒起源并不独特,因为巴德尼克、汤普森和同事们很快将发表一项研究,展示生物如何利用其他形成衣壳的逆转录转座子。每一个新的例子都会给研究人员带来结构和功能上的谜团。也许他们也会揭示更多的奇迹,比如Arc分子是如何帮助召唤我们头脑中运行的思想的。
安迪·Extance是一位生活在英国埃克塞特的科学作家











暂无评论